O čem to celé je
Skla jsou intenzivně zkoumanou skupinou nekrystalických materiálů především díky řadě jejich technicky významných vlastností, které je předurčují jako optimální materiály pro použití v optice (optické prvky, optická vlákna) a elektronice (optické i operační paměti) ve formě vláken, tenkých vrstev i objemových vzorků. K dosažení optimálních výsledků při výrobě těchto materiálů, které se používají nejen ve formě zcela skelné, ale i v částečně zakrystalizované podobě, je třeba dobrého popisu vlastností těchto materiálů. Při přípravě skelně-krystalických materiálů je rozhodující především znalost kinetiky růstu krystalů v podchlazené tavenině a popis tohoto procesu pomocí vhodného teoretického modelu.
Sklo
Sklo [DIPL 1] je homogenní izotropní látka vznikající ochlazením taveniny některých anorganických i organických látek. Vyznačuje se náhodným nepravidelným uspořádáním základních částic (ionty, atomy, molekuly) v prostoru – tedy jeho struktura je amorfní a postrádá jakékoliv pravidelné uspořádání na delší vzdálenost, na rozdíl od krystalů. Ochlazení taveniny musí proběhnout dostatečně rychle z důvodu zabránění krystalizace. Sklo je z termodynamického pohledu nerovnovážný systém s Gibbsovou energií vyšší než u látek krystalických.
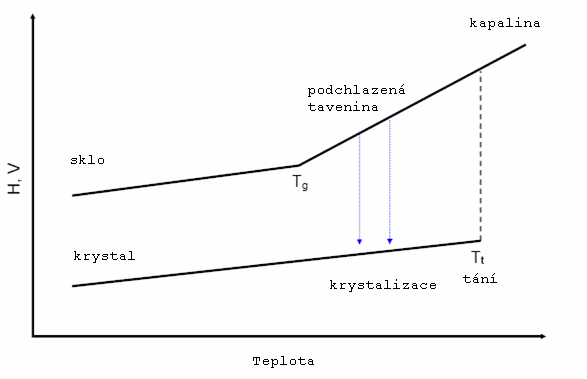
Na obrázku 1 je uvedena teplotní závislost entalpie a objemu látky [DIPL 2] pro systém v krystalické formě a pro sklo (amorfní látku). Pokud se nacházíme v oblasti s teplotou vyšší než je teplota tání, látka je v kapalném stavu. Při poklesu teploty pod teplotu tání mohou nastat dva případy. Pokud je rychlost chlazení dostatečně vysoká, nedojde ke skokové změně objemu ani entalpie a vznikne tzv. podchlazená tavenina. V případě, že je rychlost chlazení nízká, atomy stihnou zaujmout příslušné pozice v mřížce a látka se stává krystalickou. Na horní křivce se nachází zlom, který označuje teplotu skelné transformace. Pod touto teplotou (při dodržení výše uvedené dostatečné rychlosti chlazení) je materiál označován jako sklo. Sklo je makroskopicky pevná látka, jejíž objem a entalpie je vyšší než v případě rovnovážného krystalu. Obě veličiny mají ovšem pro sklo i krystal velmi podobnou teplotní závislost.
Celá řada skel patří mezi technicky významné látky. Jejich optické, mechanické i termické vlastnosti lze ovlivnit změnou složení. Mezi důležité vlastnosti patří například teplota skelné transformace Tg, změna kapacity v oblasti skelné transformace ΔCp, hodnota krystalizační entalpie ΔH nebo teplota krystalizace. K určení těchto vlastností popisujících vybrané sklo je vhodné prozkoumat oblast skelné transformace a krystalizace studovaného materiálu.
Skelná transformace je přechod ze stavu podchlazené kapaliny do termodynamicky nerovnovážného skelného stavu.
Teplota skelné transformace [DIPL 2] odpovídá teplotě, nad kterou se systém chová jako tavenina a pod ní jako pevná látka. Jak již bylo uvedeno výše, hodnota objemu a entalpie, ale také Gibbsovy energie je ale vyšší, než by odpovídalo příslušnému krystalu. Hodnota teploty skelné transformace, dále již jen Tg, není termodynamickou veličinou. Je závislá mimo jiné na stupni relaxace skla a na rychlosti chlazení při jeho přípravě.
Hodnotu Tg lze získat z naměřených závislostí tepelného toku na teplotě jako teplotu odpovídající bodu ležícímu v průsečíku poloviční vzdálenosti linií DSC křivek před a po skelné transformaci a křivky samotné.
Další důležitá teplotní oblast [DIPL 2] se nachází v oblasti blízké pod teplotou skelné transformace. Při zahřátí skla na tuto teplotu dochází k jeho relaxaci, kdy se daný systém postupně přibližuje k rovnováze.
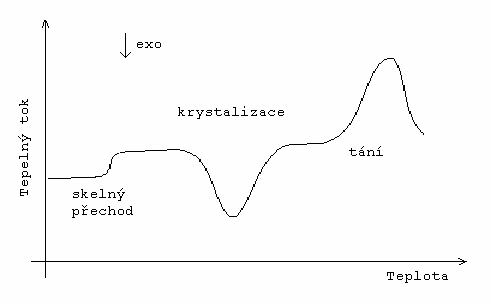
Na opačné straně od Tg, tedy při vyšších teplotách, se nachází oblast krystalizace (Obr. 2). Tento děj se skládá ze dvou fází [DIPL 2]. V první vznikají zárodky (nuklea) a po jejich vzniku začíná druhá etapa této fázové přeměny – postupné narůstání krystalu. Je tedy patrné, že při krystalizaci dochází k uspořádání (přeuspořádání) atomů, pro které je nejdůležitější dostatečně rychlý transport hmoty přes nově vzniklé fázové rozhraní a zároveň transport hmoty na místo růstu krystalu (k tomuto fázovému rozhraní). Výsledkem krystalizace je dosažení termodynamicky stabilního stavu s minimální hodnotou Gibbsovy energie – v tomto případě krystalu.
Krystalizace může být vyvolána, nebo případně urychlena působením například světla nebo elektrického pole. Tohoto jevu se hojně využívá například při optickém záznamu informací (disky CD, DVD a novější), kdy je materiál zahřát pomocí osvětlení laserem o vysoké intenzitě na potřebnou teplotu a dojde ke změně jeho struktury. S tím je spojená i změna vlastností, jako je index lomu, optická propustnost a reflektivita. Zapsaný údaj je poté možné přečíst pomocí stejného paprsku s nižší intenzitou bez vyvolání dalších změn (a tedy i zničení zaznamenané informace).
Diferenciální skenovací kalorimetrie (DSC)
Diferenciální skenovací kalorimetrie (dále již jen DSC) je běžnou experimentální technikou při studiu kinetiky nejrůznějších procesů. Výstupem z měření DSC je závislost tepelného toku mezi vzorkem a referenčním materiálem na teplotě nebo čase. Z toho vyplývá i konstrukce přístroje, který obsahuje dvě měřící cely (citlivé zóny) pro referenční materiál a vzorek.
Existují dva typy DSC přístrojů [DIPL 23] rozdělených podle typu detekce kalorimetrického signálu – tepelně vodivostní a kompenzační. Tepelně vodivostní kalorimetr registruje při měření teplotní rozdíl mezi oběma celami, podobně jako diferenční termická analýza, a tento signál následně převádí na tepelný tok. Kompenzační kalorimetr zaznamenává tepelný tok jako množství energie potřebné ke kompenzaci nastalé teplotní změny způsobené proběhnuvším dějem. Kompenzace probíhá mikropříhřevem v citlivé zóně kalorimetru.
Vzhledem k tomu, že zaznamenané množství energie je závislé na hmotnosti vzorku, je třeba pro možné porovnání tvarů naměřených křivek ještě zohlednit navážky jednotlivých vzorků. Tím se dostaneme z původních hodnot výstupu v jednotkách W (mW) na jednotky vztažené na hmotnost W/g.
Měření pomocí DSC je možné použít na širokou škálu dějů (fázová změna, adsorpce/desorpce) a převážně pro pevné látky (určení čistoty, změna modifikace, určení hodnoty změny tepelné kapacity a další). Získané informace lze využít například k charakterizaci látky nebo pro kinetickou analýzu (nalezení kinetického modelu a určení jeho parametrů).

Při vyhodnocení DSC křivky v oblasti skelného přechodu (Obr. 3) je třeba určit dvě přímky (červeně) jako prodloužené linie experimentálních dat před a za skelným přechodem. Dalším krokem je vytvoření zelené linie procházející středem mezi červenými přímkami a jí příslušející modré přímky, jejíž směrnice odpovídá derivaci v průsečíku zelené přímky a experimentálních dat. Tento bod je určen jako teplota Tg. Průsečíky modré přímky s červenou pod teplotou Tg je označována Ton, nad teplotou Tg je označována Tof. Hodnota Δcp je určena vzdáleností červených přímek v místě teploty Tg.
Z měření na DSC je možné získat všechny potřebné údaje (již uvedené výše) pro popis důležitých vlastností vybraného materiálu (teploty počátku, maxima a konce studovaného efektu a tepelné změny s efektem spojené), které jsou nezbytné i pro následnou kinetickou analýzu.